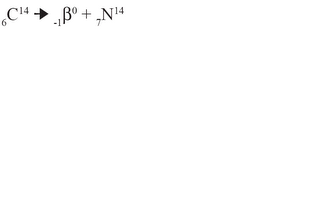Thursday, December 21, 2006
- Questão 35
- A alternativa D é falsa.
* Todos sabem que os fenois são menos ácidos que os ácidos carboxílicos (regra geral).
* Cuidado!!!!!
O pH depende da concentração de H+.
Depende da ionização do fenol e da ionização do ácido acético.
Quanto maior a ionização - maior a concentração de H+ - menor o pH.
A concentração do fenol e do ácido acético determinam a concentração de H+.
- Questão 20
* A questão:
O potencial-padrão........ , a 298K.
A partir desses dados, analise as afirmativas a seguir, e assinale a (s) correta (s).
- Não foi citado no enunciado a presença da platina (Pt).
- O padrão convencional de representação simbólica, usado no ensino médio, não foi respeitado.
- Mn/Mn +2//Cl 2/2Cl-
Wednesday, December 13, 2006
- Nos processos de transmutação nuclear ocorre a conservação do nº de massa e do nº atômico.
- Nos processos de transmutação nuclear a massa não se conserva, parte dela se transforma em energia.
- EX:
* O nº de massa no reagente é = a soma do nº de massa nos produtos = 14
* O nº atômico no reagente é = a soma do nº de massa nos produtos = 6
Monday, December 11, 2006
- Dada a reação:
N2 (g) + O2 (g) -------- 2 NO (g) entalpia= +21,5 Kcal/mol de NO
Qual a quantidade de calor envolvida na formação de 90g de NO?
Dado:N=14; O=16
* Determinando a massa de um mol de NO.
1 mol de NO ------------ Massa molar do NO = 30g
* Entalpia > 0 = endotérmico.
* 30g de NO --------------- absorvem 21,5 Kcal
90g de NO --------------- X
X = absorvem 64,5 Kcal.
Friday, December 08, 2006
- Conhecimentos gerais (prova A)
Questão nº 33
alternativa correta: D
* o gráfico representa uma mistura eutética e não uma substância. A substância deve apresentar ponto de fusão e ponto de ebulição. Notamos que no intervalo correspondente a passagem líquido para vapor (D) a temperatura não é constante.
- Biológicas (prova A)
Questão nº 19
afirmativa 016: correta
* encontramos entre outras, duas funções: amina e éter.
* encontramos 4 anéis, sendo 3 heterocícliclos e um aromático.
* encontramos carbonos com hibridação sp 2
* OBS: para ser considerada errada:
-apenas duas funções orgânicas: éter e amina;
Questão nº 20
- Analisando, como pede o examinador, os dados da questão:
- A seta em um único sentido na reação: Mn(s) + Cl2(g) ------ MnCl2(aq).
- O potencial de célula com valor positivo (2,54).
- Conclusão: ocorre um fenômeno pilha.
afirmativa 001: errada
* as semi-reações que ocorrem nos eletrodos são de redução no cátodo e oxidação no ânodo.
cátodo: Cl2(g) + 2e ------ 2Cl-
ânodo: Mn(s) ------ Mn+2 + 2e
* OBS: para ser considerada correta:
-As semi-reações padrão que ocorrem podem ser dadas por:
* OBS: caso não concorde com a observação, concluimos que ela permite dupla interpretação.
afirmativa 002: errada
* A convenção utilizada para a representação simbólica de pilhas é:
semi-reação parcial de oxidação (separando as espécies por /) // semi-reação parcial de redução (separando as espécies por /)
Mn/Mn +2 // Cl 2 /Cl -
afirmativa 032: correta
* Na pilha, o pólo positivo é o cátodo e no cátodo ocorre redução:
Cl 2(g) + 2e ----- 2 Cl - (aq)
* OBS: deve ter ocorrido um ploblema de digitação:
- deve estar faltando um desenho da pilha.
Questão nº 21
afirmativa 032: ??????????
* possui as funções álcool e alqueno.
* se considerarmos alqueno como função, o correto seria função cicleno.
* como a maioria dos alunos marcou como correta.
* heheheheheheehehe.
Questão nº 22
afirmativa 002: errada
* na estrutura do glicerídio falta um átomo de carbono, que representa o grupo funcional éster.
* ocorreu um problema de digitação.
* sem o problema na estrutura, a afirmativa estaria correta.
- Exatas (prova A)
Questão 07
afirmativa 004: correta
* a concentração de partículas na solução de KCl é 0,2mol/L.
* a pressão de vapor da solução de KCl é menor que a presão de vapor da solução de uréia (concentração 1,0 mol/L de partícula).
* a curva da solução de KCl deve ficar a esquerda da curva II, que é da solução de uréia.
* OBS: deve ter ocorrido um problema de digitação:
- a solução de uréia teria uma concentração 0,1 mol/L e não 1,0 mol/L.
Thursday, December 07, 2006
Resolução da prova: UFMS - 2007 (exatas)
06)
- 001 - 3,5mols de NO2 = 10,5 mol de átomos; 1,5 mols de N2O5 = 10,5 mol de átomos.
- 002 - 100g de Na = 4,35 mol de átomos; 50g de Li = 7,14 mol de átomos.
- 004 - 1 mol de moléculas de água =18g; 1 mol de moléculas de CO2 = 44g.
- 008 - 1 molécula de água = 18 u.
- 016 -
6 . 10 23 moléculas ---------- 180g
1,2 . 10 23 moléculas ---------- X
X = 36g
Soma = 020
07)
- 001 - o solvente puro apresenta maior pressão de vapor que a sua solução em uma mesma temperatura.
- 002 - a temperatura de ebulição da solução é maior que a do solvente puro em uma mesma pressão.
- 004 - a concentração de partículas na solução de KCl (0,2 mol/L) é maior que na água e menor que na solução de ureia (1,0mol/L), logo, a curva estará entre as curvas I e II.
- 008 - na temperatura de ebulição, a pressãode vapor é igual a pressão atmosférica para todos os casos .
- 016 - quanto maior a concentração de partículas, maior a temperatura de ebulição.
Soma - 013
08)
- 001 - o cromo no dicromato de potássio sofre redução, logo, o carbono no álcool sofre oxidação.
- 002 - o álcool é oxidado para aldeído.
- 004 - há a oxidação de etanol para etanal.
- 008- o etanol (álcool) sofre oxidação e forma etanal (aldeído).
- 016 - o pH aumenta pelo consumo do ácido na reação.
- 032 - o dicromato de potássio atua como agente oxidante porque o cromo sofre redução.
Soma - 025
09) 50 mL de cloreto de alumínio (1 mol/L) = 0,05 mol de cloreto de alumínio
- AlCl3 ----------- Al +3 + 3 Cl -
- 0,05 mol.............0,05 mol............0,15 mol
50 mL de cloreto de potássio (1 mlo/L) = 0,05 mol de cloreto de potássio
- KCl ------------ K + + Cl -
- 0,05 mol.........0,05 mol...........0,05 mol
[Al +3] = 0,05/0,1 = 0,5 mol/L
[Cl - ] = 0,20/0,1 = 2,0 mol/L
[K+] = 0,05/0,1 = 0,5 mol/L
soma das concentrações = 3,0 mol/L
Resp - 003
10) Um volume de 1,875 L de óleo (d=0,8 g/mL) = 1500g de óleo
- A massa de enxofre é 0,2% da massa de óleo = 3g de enxofre
- 32g de enxofre ------------------------ 64g de dióxido de enxofre
- 3g de enxofre -------------------------- X
X = 6g
Resp - 006
11)
- 001 - aumentando a temperatura --- aumenta a ionização --- aumenta a [H+] e [OH-] ---aumentando Kw.
- 002 - aumentando o Kw --- [H+]>10 -7 --- pH<7
- 004 - aumentando a temperatura, o equilíbrio desloca para o lado endotérmico (quebra de ligações).
- 008 - alterando a temperatura, o equilíbrio desloca para o lado endotérmico ou exotérmico.
- 016 - a introdução do catalisador não desloca o equilíbrio.
Soma - 005
12) Na eletrólise em série:
- nº de equivalentes do Ni = nº de equivalentes da Ag
- massa Ni/ equivalente Ni = massa Ag /equivalente Ag
equivalente Ni = mol/V = 59/2 = 29,5g
equivalente Ag = mol/V = 108/1 =108g
- 12,02/29,5 = massa Ag/108
- massa Ag = 44g
Resp - 044
13) C2H6O + 3 O2 ------------ 2 CO2 + 3 H2O ( - 326 Kcal/mol )
0,115 L de etanol (d=0,8 g/mL) = 92g
- 46g de etanol ------------------------- liberam 326 Kcal
- 92g de etanol ------------------------- X
X = liberam 652 Kcal
o rendimento do processo é 66,72%
- 100% rendimento ------------------ libera 652 K cal
- 66,72% rendimento ---------------- X
X = libera 435 Kcal
- 10 Kcal ------------------------ vaporizam 18g de água
- 435 Kcal -------------------------------- X
X = 783g
Resp - 783
14)
- 001 - o polímero é gerado pela condensação de uma diamina e um diácido. O monômero com caráter básico é a diamina.
- 002- o nylon é um polímero de condensação do hexametilenodiamino (1,6-diaminoexano) e ácido adípico (ácido hexanodióico).
- 004 - o nylon é uma poliamida.
- 008 - o dexon é um polímero de condensação que apresenta a função éster.
- 016 - o monômero do PVC é o cloreto de vinila.
- 032 - o monômero do dexon é o ácido 2-hidróxietanóico que apresenta as funções álcool e ácido caroxílico.
Soma - 042
15)
- 001 - a 80°C a solubilidade de x é 100g/100g de água e a solubilidade de y é 175g/100g de água. Na temperatura de 100°C a solubilidade de y é 250g/100g de água.
- 002 - a cristalização é mais eficiente para y (maior variação da solubilidade com a temperatura) e menos eficiente para z (menor variação da solubilidade com a temperatura).
- 004 - a 80°C a menor quantidade de água para para dissolver 140g de y é 350g.
40g de y ------------------- 100g de água
140g de y ------------------- X
X = 350g de água
- 008 - aumentando a temperatura, a solubilidade do NaCl aumenta muito pouco e a solubilidade do nitrato de potássio aumenta muito.
- 016 - o aumento da temperatura aumenta a dissolução (dissolução endotérmica).
- 032 - em temperaturas menores que 50°C a solubilidade do nitrato de potássio é menor.
Soma - 009
Wednesday, December 06, 2006

UFMS - 2007
PROVA DE CONHECIMENTOS ESPECÍFICOS -
BIOLÓGICAS (prova A)
16) A massa de alumínio
- m = 500.81/100 = 405g
O nº de mols de átomos de alumínio
- n = m/Mol = 405/27 = 15 mols
Resp - 015
17) A concentração da solução inicial
- C = 1,2 ppm = 1,2 mg/L = 1,2 . 10 -3 g/L
A concentração da solução inicial em mol/L
- C = Mol.M
- M = C/Mol = 1,2. 10 -3 / 19 mol/L
Na evaporação o volume reduz de 2/3
- V = 4 - (4.2/3) = 4 - 8/3 = 4/3 L
Aplicando a lei da diluição
- Mi . Vi = Mf . Vf
- (1,2 . 10 -3 / 19) . 4 = Mf . 4/3
- Mf = 3.(1,2 . 10 -3 /19) mol/L
Comparando as molaridades
- Mf = 3 . Mi
Resp - 003
18) Balanceando a equação
- Ca3(PO4)2 + 3 H2SO4 ----- 3 CaSO4 + 2 H3PO4
Relação entre fosfato de cálcio e ácido fosfórico
- 1 mol Ca3(PO4)2 ------------- 2 mol H3PO4
- 310g--------------------------------196g
- 15,5 t-------------------------------- X
- X = 9,8 t
Levando em conta o rendimento
- 9,8 t ------------------- 100%
- X ------------------------51,03%
- X = 5 t
Resp - 005
19)
- 001 - pode ocorrer isomeria óptica na anfetamina devido a existência de carbono assimétrico.
- 002 - a estrutura apresenta dois grupos funcionais éster.
- 004 - as funções encontradas na estrutura, da direita para a esquerda, são: fenol, amina, amida, tioéter e ácido carboxílico. Apresenta 4 carbonos assimétricos ou quirais.
- 008 - o aspartame não apresenta a função éter.
- 016 - o sildenafil apresenta as funções amina e éter, três aneis heterocíclicos e um aromático e 11 carbonos híbridos sp 2.
Soma - 021
20)
- 001 - analisando a reação de célula, o manganês deve oxidar e o cloro deve reduzir.
- 002 - a representação simbólica da célula:Mn/Mn +2 // Cl2/2Cl -
- 004 - reação espontânea apresenta potencial de célula positivo.
- 008 - na pilha:
d.d.p = E oxi + E red
2,54 = E oxi + 1,36
E oxi = + 1,18 V ,logo o E red = - 1,18 V
- 016 - agente oxidante é a substância que apresenta o elemento que reduz, logo, o gás cloro é o agente oxidante.
- 032 - Na pilha o polo positivo é o cátodo e cátodo é onde ocorre redução:
Cl 2 + 2 e ------- 2 Cl-
Soma - 040
21)
- 001 - encontramos 2 carbonos com dupla ligação, logo, carbonos sp 2.
- 002 - é um esteroide de origem animal presente em todos os tecidos.(??)
- 004 - sofre halogenação, por adição, em condições apropriadas.
- 008 - sofre hidrogenação catalítica em condições apropriadas.
- 016 - não apresenta cadeia aromática.
- 032 - apresenta insaturação em cadeia cíclica (cicleno).
Soma - 007
22)
- 001 - o biodiesel é um combustivel biodegradavel e renovável, obtido pelo craqueamento, esterificação ou transesterificação. Pode ser produzido a partir de de gordura animal ou óleo vegetal. Pode ser usado puro ou misturado ao diesel em qualquer proporção.
- 002 - a transesterificação é uma das técnicas de produção de biodiesel.
- 004 - o nome oficial é 1,2,3-propanotriol (propanotriol).
- 008 - o éster derivado do etanol na transesterificação deve apresentar somente dois oxigênios ligados ao oxigênio.
- 016 - nos grupos - (CH2) - os carbonos podem fazer apenas ligações simples.
- 032 - o biodiesel é uma mistura de ésteres derivados do metanol ou etanol em reação de transesterificação.
Soma - 051
23)
- 001 - a equação de velocidade é:V = K. (pA).(pB) elevado a expoentes determinados experimentalmente. Mantendo as massas constantes e reduzindo os volumes à metade as pressões dobram:Pa . V = nA . R . T ; pA' . V/2 = nA . R . T ; pA' = 2 . pA. Caso a reação seja de ordem 1 para os dois reagentes, a velocidade deve ficar 4 vezes maior.
- 002 - a equação de velocidade é:V =K . [A] 2.Dobrando a concentração de A a velocidade deve quadruplicar.
- 004 - aumentando a temperatura a velocidade das reações aumentam, porque aumentam o nº de colisões entre as moléculas.
- 008 - na autocatálise, a formação do produto acelera a reação.
- 016 - o ativador aumenta o efeito do catalisador.
- 032 - na catálise heterogênea, reagente e catalisador formam um sistema heterogêneo.
Soma - 042